建宁县第一中学 All rights reserved
违法和不良信息举报电话:0598-3982010 举报邮箱:fjjnyzbgs@126.com 举报入口
本站已通过国家IP/ICP备案 备案编号:闽ICP备2020018089号

|
|
学科:化学 类型:高三备课组活动
时间:12月12日 地点:广泉楼2楼办公室
主讲人:李贵花
主要内容:化学反应速率集体备课
【复习目标】
1.能进行化学反应速率的简单计算。
2.能通过实验探究或用一定的理论模型分析说明外界条件改变对化学反应速率的影响。
3.能运用温度、浓度、压强和催化剂对化学反应速率的影响规律解释生产、生活、实验室中的简单实际问题,能讨论化学反应条件的选择和优化。
【知识精讲】
考点一 化学反应速率
1.含义:化学反应速率是用来衡量化学反应快慢的物理量。
2.常用表示方法及计算
如在密闭容器中,合成氨的反应N2+3H2 2NH3,开始时c(N2)=8 mol·L-1,2 min后c(N2)=4 mol·L-1,则用N2表示的反应速率为2mol·L-1·min-1。
3.与化学计量数的关系
同一反应在同一时间内,用不同物质来表示的反应速率可能不同,但反应速率的数值之比等于这些物质在化学方程式中的化学计量数之比。
对于已知反应mA(g)+nB(g)===pC(g)+qD(g),其化学反应速率可用不同的反应物或生成物来表示,当单位相同时,化学反应速率的数值之比等于化学计量数之比,即v(A)∶v(B)∶v(C)∶v(D)=m∶n∶p∶q。
4.化学反应中各物质浓度、反应速率的计算模式——“三段式”
(1)写出有关反应的化学方程式。
(2)找出各物质的起始量、转化量、某时刻量。
(3)根据已知条件列式计算。
5.化学反应速率大小的比较方法
由于同一化学反应的反应速率用不同物质表示时数值可能不同,所以比较反应的快慢不能只看数值的大小,而要进行一定的转化。
(1)看单位是否统一,若不统一,换算成相同的单位。
(2)单位统一后,换算成同一物质表示的速率,再比较数值的大小。
(3)也可以直接比较化学反应速率与化学计量数的比值。
即对于一般反应aA+bB===cC+dD,比较与,若>,则A表示的反应速率比B的大。
考点二 化学反应速率的影响因素
1.影响化学反应速率的因素
(1)内因:反应物本身的性质是主要因素。如相同条件下Mg、Al与稀盐酸反应的速率大小关系为Mg>Al。
(2)外因(只改变一个条件,其他条件不变)
2.用图像表示浓度、温度、压强对化学反应速率的影响
3.基元反应和有效碰撞理论
(1)基元反应:大多数化学反应往往经过多个反应步骤才能实现,每一步反应都被称为基元反应;先后进行的基元反应反映了反应历程,反应历程又称为反应机理。
(2)有效碰撞
①基元反应发生的先决条件是反应物的分子必须发生碰撞。
②反应物分子的每一次碰撞并不是都能发生反应,能够发生化学反应的碰撞叫作有效碰撞。发生有效碰撞的两个条件是反应物分子能量足够和取向合适。
(3)活化分子、活化能
①活化分子:能够发生有效碰撞的分子。
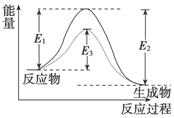
②活化能:如图
图中:
E1为正反应的活化能,E2为活化分子变成生成物分子放出的能量;使用催化剂时的活化能为E3,反应热为E1-E2。(注:E2为逆反应的活化能)
③有效碰撞:活化分子之间能够引发化学反应的碰撞。
(4)活化分子、有效碰撞与反应速率的关系
4.气体反应体系中充入“惰性气体”(不参与反应)时对反应速率的影响
(1)恒容:充入“惰性气体”→总压增大→物质浓度不变(活化分子浓度不变)→反应速率不变。
(2)恒压:充入“惰性气体”→体积增大→物质浓度减小(活化分子浓度减小)→反应速率减小。

![]()